Заказ OnLine : Ваша корзина
Что происходит с ионами протактиния в воде
Находящийся в земной коре только в следовых количествах, но при этом выступающий в качестве альтернативы существующим видам ядерного топлива, редкий элемент протактиний демонстрирует химическое поведение, которое отличает его от соседних по таблице актиноидов, в том числе и урана.
Исследователи из Аргоннской национальной лаборатории и Национальной лаборатории Лоуренса Беркли продемонстрировали, что в отличие от урана и плутония ион в водном растворе протактиний не может существовать в виде PaO2+.
Это обстоятельство обуславливается энергией гидратации иона PaO2+, значение которой достаточно для расщепления молекулы воды. Для оксоионов плутония и урана такое поведение не характерно.
Полученные результаты позволяют глубже понять химию водных растворов протактиния и других актиноидов. Химия протактиния особенно сложна для изучения из-за своей сложности и рассеянности протактиния, однако свойства этого элемента необходимо изучать как для возможности его применения в качестве топлива для ядерных реакторов, так и для систематизации химических свойств f-элементов.
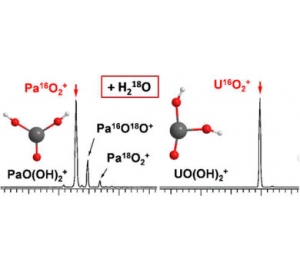
Было обнаружено, что протекающий в газовой фазе кислородный обмен иона PaO2+ с водой протекает значительно быстрее, чем у аналогичного по строению UO2+. Это наблюдение позволяет говорить о том, что связи Pa-O легче активируются к образованию бис-гидроксидного интермедиата PaO(OH)2+. Для выяснения природы продукта взаимодействия воды с PaO22+ в ионной ловушке были изучены процессы гидратации PaO2+ и UO2+.
Резульдаты исследования говорят о том, что в отличие от UO2(H2O)+, образующаяся в газовой фазе частица PaO(OH)2+ близка по энергии к изомерному ей продукту гидратации PaO2(H2O)+. Результаты, полученные для газовой фазы, согласуются с результатами, наблюдаемыми для самопроизвольного гидролиза PaO22+. Это наблюдение противоречит поведению в водном растворе диоксидов урана, нептуния и плутония, которые образуют стабильные гидраты и в водном растворе, и в газовой фазе. Исследователи делают вывод о том, что стабильность оксо-гидроксидов изменяется в том же порядке, что и стабильность гидратов оксидов: Th(IV) > Pa(V) > U(V) > Np(V) > Pu(V). Этот ряд соответствует увеличения ковалентного характера и понижению ионности связи актиноид-кислород.











