Заказ OnLine : Ваша корзина
Новое определение гипервалентности вызывает дискуссии
Исследователь из Великобритании предлагает новое противоречивое определение гипервалентности. Это определение может стать поводом для многочисленных дискуссий о природе химических связей, атомных и молекулярных зарядов, а также позволит не считать ошибкой изображенный студентом пятивалентный азот.
Маркус Даррэнт из Университета Нортумбрии описывает свой подход к концепции гипервалентности как возвращение к простому изображению структурных формул, не требующее проведения квантовохимических расчетов. Сводя воедино результаты подсчета электронов на атомах в различных версиях резонансных структур, исследователь вводит параметр «эквивалента валентных электронов» (valence electron equivalent), указывающий на общее число электронов, связанных с каждым атомом молекулы. Если этот параметр для какого-то атома превышает восемь, это говорит о гипервалентности этого атома.
Традиционно гипервалентным считается любой атом, для которого нарушается правило октетов Льюиса за счет связывания с большим числом соседних атомов, чем позволяют его валентные электроны. Так, сера в диоксиде серы (O=S=O) гипервалентна, поскольку атом серы связан более чем с восемью валентными электронами. Кислородсодержащий «аналог» диоксида серы – озон (O=O+–O–), напротив, не содержит гипервалентные атомы, поскольку элементы второго периода не могут расширять свой октет за счет участия в образовании молекулярных орбиталей более высоких по энергии орбиталей атомных, поэтому в школе и в вузе формулу озона учат писать, изображая формальные заряды на атомах.
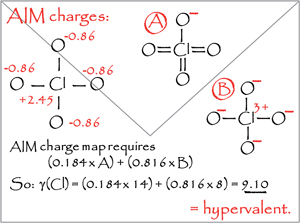
На основании своего опыта изображения химической связи для студентов Даррэнт и решил переосмыслить концепции химической связи, озадачившись следующими вопросами: «Почему правильно изображать нейтральный диоксид серы с большим количеством связей, чем позволяет количество s- и p-орбиталей у центрального атома серы, в то время как единственный приемлемый способ отображения строения озона – отображение одинарной связи зарядов?». Даррэнт объяснял такие правила отображения структур традициями, заложенными еще Льюисом в начале ХХ века. Тем не менее, эти же традиции не могут дать нам ответ на вопрос, как следует правильно отображать диазометан (CH2N2). Формально следование «октетному» подходу говорит о том, что нам следует записать его структуру как H2C––N+=N, однако такая формула (и в первую очередь отрицательный заряд на углероде) не отражает реакционную способность диазометана.
Квантовая химия продемонстрировала энергетическую невыгодность участия d-орбиталей в образовании дополнительных связей, что фактически исключает возможность применения квантово-механических моделей для льюисовского связывания. Связи кислород-сера в диоксиде серы полярны, что позволяет приписать атому серы формальный заряд +2, что, в свою очередь дает возможность отойти от концепции гипервалентного состояния атома серы.
Параметр гипервалентности, предложенный Даррэнтом, является выражением идеи того, что строение многих молекул можно описать через несколько граничных резонансных форм, при этом реальная структура представляет собой суперпозицию этих резонансных структур. Для каждой резонансной формы мы можем приписать каждому атому определенное число электронов, а реальное число электронов, локализованных у определенного атома, должно зависеть от вклада каждой резонансной структуры в общую картину. Возможность определения зарядов на атомах позволяет оценить общее число электронов.
По словам Даррэнта, льюисовские структуры делают фундаментальные предсказания о локализации атомных зарядов, поэтому измерение величин заряда нисколько не противоречит той самой модели Льюиса, которой обучают в школе и на первых курсах вуза. Тем не менее, в настоящее время не существует единообразия в подходах определения атомных зарядов. Для определения этих параметров применяют различные модели, такие как концепция натуральных связевых орбиталей (NBO), модели Хиршфилда и Малликена, однако результаты, применяющиеся при использовании различных подходов, также могут различаться.
В рамках своего подхода к описанию гипервалентного состояния Даррэнт решил использовать значения зарядов, которые вычисляются по квантовой теории атомов в молекулах (QTAIM) Ричарда Бейдера. Хотя эта модель является теоретической, среди ряда ученых существует мнение, что близкие к результатам применения этой модели значения зарядов можно и наблюдать на практике. Таким образом, Даррэнт считает, что новая концепция может отойти от сложностей интерпретации порядков связей силами квантовой химии и перейти к использованию данных, получаемых экспериментально. Даррэнт также подчеркивает, что заряды, определенные по алгоритму QTAIM, коррелируют с электроотрицательностью атомов, хотя пока и непонятно, в чем логика этой взаимосвязи.
Маттиас Бикельхаупт, химик-теоретик из Университета Амстердама, предостерегает от попыток воспринимать новое определение гипервалентности как физическую модель, обладающую силой объяснения или предсказания. Он полагает, что отсутствие прямых и ясных взаимоотношений между параметром Даррэнта, энергией связи и геометрией молекул ограничивает новое описание гипервалентного состояния атома только до индикатора, способного применяться исключительно для феноменологической классификации соединений.
И на самом деле, заряды атомов, определенные с помощью модели QTAIM, не согласуются с результатами расчетов по Хиршфилду и Малликену, и самое худшее, что параметр Даррэнта основан на не самой точной физической модели. Тем не менее, этот параметр хорошо согласуется с зарядами, рассчитанными по методу NBO, а также есть возможность его экспериментальной проверки. В качестве возможных причин объяснения несоответствия высказывается и недостаточная точность подсчета зарядов по Хиршфилду и Малликену.
Сам исследователь заявляет, что для него его работа помимо прочего представляет собой хороший пример взаимодействия исследования с обучением, при котором мы не только учим, но и спрашиваем – чему мы учим. Он подчеркивает, что современный подход к преподаванию гипервалентности позволяет буквально на пальцах вывести некоторые правила, соблюдаемые рядом молекул, однако при этом, по словам создателя новой концепции, возможно, не стоит сильно ругать студентов, которые изображают нитрогруппу [–NO2] с пятивалентным азотом, поскольку такое изображение нельзя считать полностью неправильным – это всего лишь часть общей картины.
Источник: Chem. Sci., 2015, DOI: 10.1039/c5sc02076j











