Заказ OnLine : Ваша корзина
Синтетическая модель природного катализатора
Исследователи разработали простой состоящий из двух молекул химический аналог фермента и субстрата, который легко позволяют продемонстрировать фундаментальные принципы биологического катализа.
Новая реакция представляет собой синтетическую модель биологического катализатора, которая позволит изучающим биохимию легче представить и понять, как протекает ферментативный катализ, новая система может не только войти в перечень лабораторных работ для практикума по общей биохимии и ферментативному катализу, но и стать основой для разработки новых биомиметических катализаторов.
В 1948 Лайнус Полинг предположил, что работа фермента основана на том, что активный центр фермента связывается более прочно с субстратом, находящимся в переходном состоянии, а десятью годами позже Дэниел Эдвард Кошланд высказал предположение и о том, что активный центр фермента меняет свои геометрические параметры для более прочного связывания с субстратом – эта теория получила название теории взаимно индуцированного стерического соответствия. К сожалению, наглядная демонстрация этих теорий на примере белковых катализаторов не удавалась из-за большого размера и сложной структуры биомолекул.
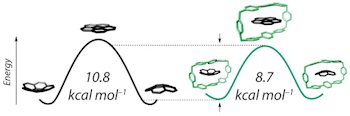
Циклический циклофан ExBox понижает энергию активации инверсии кораннулена, в результате чего происходит десятикратное ускорение реакции.
В новой работе исследователи из лабораторий Джея Сигеля и Фрейзера Штоддарта демонстрируют простой аналог, позволяющий продемонстрировать ключевые особенности биологического катализа.
В качестве модели активного центра фермента исследователи использовали прямоугольный циклофан ExBox, вещество, ключевым элементом которого являются бипиридиновые структуры. В качестве субстрата был выбран полициклический ароматический углеводород кораннулен, форма которого напоминает чашу, а в качестве модельной реакции – реакция инверсии кораннулена. В ходе реакции кораннулен связывается с полостью ExBox таким образом, что чаша кораннулена слегка уплощается, а полость ExBox незначительно увеличивается для более оптимального связывания – таким образом и «фермент», и «субстрат» меняют свою форму для более оптимального взаимодействия. При связывании ExBox-кораннулен с моделью фермента взаимодействует несколько более уплощенное переходное состояние кораннулена, в результате чего в присутствии ExBox скорость процесса инверсии кораннулена возрастает десятикратно.
Эта последовательность процессов, равно как и величины энергий связывания кораннулена в основном (чашеобразном) и возбужденном (уплощенном) состояниях была подтверждена с помощью методов ЯМР, кристаллографии, изотермической калориметрии. Полученные эмпирическим путем данные хорошо соответствовали результатам квантово-химических расчетов.
Как отмечает Сигель, исследователи смогли продемонстрировать на исключительно простой системе работу принципов, характерных для куда более сложных биологических систем, а также определить все параметры, ключевые для оптимального связывания катализатор-субстрат.
Комментируя результаты исследования, Лоуренс Скотт из Бостонского Колледжа (США) заявляет, что простота новой системы позволяет надеяться на то, что в перспективе она может стать классической иллюстрацией теоретических концепций ферментативного катализа.











