Заказ OnLine : Ваша корзина
Агостические изомеры дают кристаллы разного цвета
Открытие того факта, что один и тот же молибденсодержащий катион может образовывать два типа кристаллов, окрашенных в разные цвета, является первым экспериментальным свидетельством в пользу существования для металлоорганических соединений агостических изомеров или агостомеров.
Кристаллы, одни из которых имеют оранжевую окраску, а другие – синюю, образуются благодаря различным агостическим взаимодействиям. Это наблюдение может стать основой для разработки новых подходов к катализу металлорганическими соединениями – именно в этих процессах слабые взаимодействия C–H/металл могут играть ключевую роль.
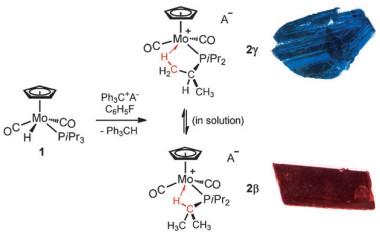
Различные агостические изомеры образуют синие или оранжевые кристаллы.
Моррис Баллок с коллегами из Северо-западной Тихоокеанской Национальной лаборатории США обнаружил агостомеры при изучении процесса гидрирования рядом комплексов молибдена. Исследователь поясняет, что в ходе изучения каталитического процесса исследователи наблюдали только координационно-насыщенные (18-электронные) металлоорганические частицы, однако несколько линий спектра позволяли предположить, что возможно участие в каталитическом цикле в качестве активных интермедиатов и координационно-ненасыщенных 16-электронных частиц.
Одна из причин пристального интереса химиков-металлооргаников к агостическим взаимодействиям кроется в том, что эти связи могут стабилизировать координационно-ненасыщенные высокореакцционные частицы за счет временной защиты координационной вакансии в металлокомплексе. На основании ранних работ исследователи выяснили, что их нестабильные 16-электронные интермедиаты могут быть стабилизированы за счет агостического взаитмодействия. При этом, как заявляет, Баллок, открытие агостомеров оказалось приятной неожиданностью.
Ключевым моментом для открытия был процесс кристаллизации интермедиата, стабилизированного фосфимновым лигандом. Агостические изомеры – агостомеры могут образоваться, если для стабилизации координационной вакансии доступен более, чем один тип связи C–H, однако прежние попытки выделения стабильных агостомеров потерпели неудачу из-за быстро устанавливающегося равновесия между агостомерами в растворе. Тем не менее, в кристаллическом состоянии взаимный переход агостических изомеров невозможно, что в итоге и привело к неожиданному выделению двух типов окрашенных кристаллов, которые образовались в результате кристаллизации одного и того же исходного вещества.
Баллок делает вывод о том, что отчасти его открытие было сделано благодаря удачному стечению обстоятельств, а точнее – тому обстоятельству, что оба агостомера присутствовали в растворе в значительных количествах, а также томук, что оба изомера образовали монокристаллы, пригодные для изучения методом рентгеноструктурного анализа. Он добавляет, что нельзя исключать того, что существует немалое количество агостических комплексов, в растворах которых содержатся агостомеры, однако для всех известных к настоящему времени систем кристаллизуется лишь какой-то один из агостических изомеров.
Жерар Паркин из Университета Колумбии (США) отмечает, что результаты исследования являются очередным аргументом в пользу того, почему открытие агостических взаимодействий оказало столь существенное влияние на отношение химиков-металлооргаников к алкильным группам.
Он подчеркивает, что Баллоку с коллегами не только впервые удалось охарактеризовать агостические изомеры структурно, но и также продемонстрировать, что различный тип агностических взаимодействий обеспечивает различие электронного строения молекул. Открытие увеличивает значимость агостических взаимодействий, которые, хоть и не всегда дают себя зафиксировать, но, тем не менее, играют существенную роль в управлении реакционной способностью металлоорганических соединений и результатах реакций, катализируемых этими соединениями.











