Заказ OnLine : Ваша корзина
Реакция Дильса-Альдера обзаводится новым катализатором
Химики-органики из США разработали метод, позволяющий контролировать стереохимию внутримолекулярной реакции Дильса-Альдера .
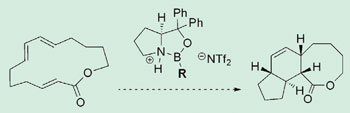
Оксазаборолидиновый катализатор позволяет сшить макроцикл.
Группа исследователей из Гарвардского Университета под руководством Эрика Якобсена (Eric Jacobsen) смогла осуществить каталитическую трансаннулярную реакцию Дильса Альдера с хорошим выходом и уровнем стереохимического контроля. Результаты исследования позволяют химикам-синтетикам использовать альтернативный способ для получения лекарственных препаратов и аналогов природных соединений.
Трансаннулярные реакции Дильса-Альдера являются ключевыми в синтезе многих природных соединений и приводят к образованию множественных хиральных центров в молекуле продукта. Зачастую контроль стереохимии всех этих центров весьма сложен, хотя и необходим.
Группа Якобсена попробовала получить ряд макроциклов с помощью катализаторов оксазаборолидиновой структуры, разработанных Кори (E J Corey). Катализаторы, которые несложно получить, содержат в структуре фрагмент кислоты Льюиса, который может координироваться с диенофилом и активировать его.
Особо значительного успеха удалось достигнуть при введении в структуру катализатора фторированного ароматического фрагмента, в результате чего исследователям удалось получить полициклические соединения с отличным выходом, энантиоселективностью и диастереоселективностью.
Исследователи продемонстрировали разносторонность разработанной методики, продемонстрировав возможность образования семи- и восьмичленных циклов, используя различные диенофилы.











